Implante de dispositivos de drenaje para glaucoma
Dispositivos de drenaje para el glaucoma o tubos
El tratamiento actual del glaucoma consiste en disminuir la presión intraocular, el principal factor de riesgo modificable. Esto evita que el glaucoma progrese y continúe disminuyendo la visión, pero lamentablemente en ningún caso, recupera ya la visión perdida. Es por esto, que el manejo precoz del glaucoma es lo único que previene la pérdida irreversible de visión. Los dispositivos de drenaje corresponden a un grupo de artefactos implantables en el ojo para derivar el humor acuoso (líquido del interior del ojo) hacia el exterior por debajo de la conjuntiva y del párpado y de esta manera disminuir la presión intraocular en pacientes adultos y niños con glaucoma. La ventaja que tienen ante la trabeculectomía es que hay menor probabilidad de que se fibrosen y fallen ya que la filtración es a través de un tubo de silicona.
Estos dispositivos de drenaje están indicados cuando ha fallado una trabeculectomía o cuando el riesgo de que falle es muy elevado, como en el caso de pacientes con glaucoma secundario a uveítis (inflamación del ojo), glaucoma neovascular (diabetes), glaucoma secundario a vitrectomía (cirugía de retina), trasplante de córnea entre otros. En la mayoría de los pacientes, tanto adulto como niños, estos dispositivos vienen a ser un segundo paso en el tratamiento de su glaucoma. El éxito reportado es de alrededor de 70 a 80% a los 5 años de seguimiento.
Existen varios tipos de dispositivos de drenaje para tratar el glaucoma. Los que yo recomiendo usar son sin válvulas: el implante de Baerveldt y el tubo de Paul. Ambos han demostrado mejor funcionamiento a largo plazo 1. En algunos casos, el implante valvulado de Ahmed es también útil. La elección del dispositivo va a depender de las características del paciente y del ojo. Estos implantes requieren algunas veces de más de un procedimiento o cirugía para regular correctamente cuanto líquido deben drenar desde el ojo y así determinar la presión intraocular óptima.
El implante esta formado de dos porciones: el tubo transparente de silicona de 0.6 mm de diámetro externo y 0.3 mm de diámetro interno que ingresa a la cámara anterior del ojo para drenar el humor acuoso y el plato hacia donde el tubo drena el liquido. El plato se posiciona debajo de la conjuntiva y del párpado superior, de esta manera evitando que sea visible. El tubo generalmente se cubre con un injerto de esclera o cornea de un donante para evitar que se erosione, exponga y se infecte con el rose que produce el parpadeo.
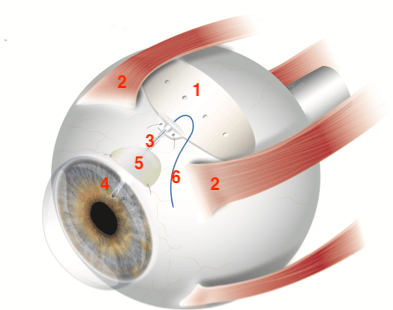
Esquema de un implante de Baerveldt implantado en un ojo. 1 es el plato del implante, en donde se formará una ampolla de conjuntiva para acumular el humor acuoso drenado. 2 el plato debe fijarse por debajo de los músculos rectos. 3 es el tubo del implante el cual es ingresado a la cámara anterior (4). 5 corresponde al parche de esclera o pericardio para proteger la parte del tubo que no ingresa al ojo. 6 es la sutura que se mete por dentro del tubo para limitar el exceso de drenaje que puede ocurrir en un comienzo.
La cirugía
Se realiza con anestesia general o local. El procedimiento dura aproximadamente 1 hora y media. La cirugía consiste en exponer la esclera en donde será el dispositivo implantado disecando la conjuntiva y aplicando mitomicina C, un agente anti cicatrizante por un par de minutos para evitar que la excesiva cicatrización impida que el dispositivo funcione correctamente. Luego, se fija el plato del dispositivo (la parte blanca grande) a la esclera por debajo de los músculos mediante un par de suturas para más tarde introducir 1 a 2 milímetros el tubo al interior del ojo por delante del iris. Una sutura se pasa por el interior del tubo para limitar el flujo de humor acuoso y prevenir que la presión disminuya mucho después de la cirugía. También se realizan un par de ligaduras al tubo las cuales se pueden ir removiendo con láser en el postoperatorio para ir ajustando la presión. La parte del tubo que queda afuera del ojo se cubre con un parche de esclera, córnea o pericardio y la conjuntiva se vuelve a su lugar cubriendo el tubo y el plato.
Post operatorio
Después de la cirugía, usted notará que su ojo está enrojecido y la visión puede estar borrosa por un par de días o incluso ver doble. Esto va mejorando en el curso de un par de semanas. Es posible que también tenga sensación de cuerpo extraño y ojo seco. Esto se puede manejar en la mayoría de las veces con lagrimas artificiales libres de preservantes.
Deberá administrarse gotas postoperatorias de antibióticos para prevenir infecciones y de corticoides tópicos antinflamatorios. Estas gotas deberán administrarse varias veces al día las primeras semanas e irán disminuyendo en el transcurso del postoperatorio. Solo deben ser administradas durante el día, en la noche podrá dormir normalmente utilizando por unos días un escudo protector para evitar el contacto del ojo con la almohada, sabana o su propia mano. Se recomienda estar con reposo laboral por alrededor de 2 semanas, dependiendo de la actividad laboral y de la recuperación de cada paciente. Las actividades deportivas deben reiniciarse de manera paulatina. No hay contraindicaciones para volar en avión o utilizar lentes de contacto un par de semanas después de la cirugía. Tenga presente que en muchos casos la presión puede estar elevada en el período inmediato después de la cirugía, producto de las ligaduras hechas al tubo. Esto significa que habrá que retomar las gotas hipotensoras por un tiempo o recibir tratamiento láser para disolver alguna de las ligaduras del tubo y permitir más flujo de acuoso disminuyendo la presión intraocular. Esto se hace de manera ambulatoria en la clínica y es un procedimiento rápido y sencillo.
El ojo tarda entre 2 a 3 meses en recuperarse completamente. En ese tiempo si la visión no es óptima, se recomienda una nueva prescripción de lentes ya que a veces esta cambia después de la cirugía.
Reportes del Moorfields Eye Hospital de Londres, muestra un éxito en adultos del 77% con una presión intraocular promedio después de la cirugía de 11.6 mmHg y solo uno de cada cuatro pacientes requería de gotas hipotensoras 2. En niños, el éxito tiende a ser un poco menor, con un 59% de éxito reportado a los 5 años de seguimiento 3.
Complicaciones
- Presión intraocular elevada después de la cirugía. Esto se puede deber a la ligadura del tubo y puede revertirse aplicando láser para disolverla o removiéndola manualmente. Esto se realiza como un pequeño y rápido procedimiento ambulatorio. Estas suturas y ligaduras son importantes para evitar que la presión intraocular sea muy baja y es un procedimiento normal el ir regulando la presión mediante la remoción selectiva de estas. Es conveniente esperar un par de semanas antes de remover las ligaduras para que se genere una cápsula sobre el plato y el implante funcione correctamente. Si la presión se mantiene muy alta en el intertanto, se pueden iniciar gotas hipotensoras. Otras veces la presión puede estar elevada incluso después de remover las ligaduras o elevarse en un largo plazo después del éxito inicial. En esos casos se puede volver al tratamiento con gotas pero generalmente en una menor cantidad que antes de la cirugía o intentar que el implante funcione mejor destapando el tubo o perforando la cápsula sobre el plato en el caso de que esté fibrosada evitando que se acumule humor acuoso abajo de ella.
- Presión intraocular muy baja o hipotonía ocular. Aun que raro (menos del 1%), esto puede causar complicaciones visuales si es mantenido por un largo tiempo. Estas complicaciones pueden ser una hemorragia coroidea o pliegues en la retina. El manejo inicial consiste en disminuir la dosis de los corticoides tópicos, inyectar un gel para reformar el ojo o finalmente agregar mas ligaduras al tubo del implante.
- Infección. En menos del 1%. Esto riesgo disminuye con el uso de gotas antibióticas en el postoperatorio. El riesgo es menor que en el caso de trabeculectomía y puede aumentar cuando hay una exposición del tubo la que se debe tratar inmediatamente.
- Erosión y exposición del implante o del tubo en menos del 3%. En estos casos, se debe recubrir nuevamente la parte expuesta para prevenir el riesgo de infección.
- Descompensación de la córnea debido a proximidad del tubo. El flujo de humor acuoso o la punta del tubo pueden producir daño en células endoteliales de la córnea si es que la punta del tubo esta muy cerca de la córnea. Esto se traduce en descompensación o edema corneal. Su manejo es mediante reposicionar o acortar el tubo y en casos avanzados requiere de un trasplante de endotelio corneal. (DMEK).
- Ptosis o parpado caído, esto puede ocurrir después de cualquier cirugía ocular y se debe a un daño en los musculos del párpado producido por el especulo o clip que se usa para mantener el ojo abierto durante la cirugía. En muchos casos se revierte espontáneamente un par de meses después de la cirugía. Si eso no ocurre, se necesita de una cirugía para levantar el parpado a su lugar original.
Alrededor del 5% de los pacientes requieren de una segunda cirugía para ajustar la presión o manejar alguna complicación.
Referencias
- Barton K. A modified stenting technique without external ligation for early flow control with the Baerveldt glaucoma drainage device. Investigative Ophthalmology & Visual Science. 2005.
- Daniel M, Mehamed-Noriega J, Petchyim S, Brookes J. Childhood glaucoma: long-term outcomes of glaucoma drainage device implantation within the first 2 years of life. J Glaucoma 2019.878-883.
Wang J, Barton K. Aqueous shunt implantation in glaucoma. Taiwan J Ophthalmol 2017;7:130-137.

